Kartoffelbatterie ?? Ja richtig! ich habe mich nicht verschrieben. Nach dem letzten Beitrag über die Stromversorgungen zum Experimentiersystem kam mir die Idee, dieses Experiment einmal hier dazustellen
Der Aufbau und die Durchführung des Experimentes sind so simpel, wie es sich anhört . Der Versuch ist ideal geeignet, um mit Kindern und Schülern erste Experimente zum Thema Elektronik durchzuführen.
Alles was mach braucht ist folgendes:
3x verzinkte Unterlegscheiben oder Schrauben
3x 5-Cent-Münzen
4x Messschnüre mit Krokodilklemmen
1x Voltmeter
1x LED
ach ja, und natürlich drei Kartoffeln
In der folgenden Bilderreihe beschreibe ich, wie der Aufbau aussieht und das Experiment durchzuführen ist.
Wie funktioniert der Versuchsaufbau:
Wenn sich zwei unterschiedliche Metalle, in unserem Fall Kupfer und Zink, in einer elektrisch leitenden Flüssigkeit befinden, dann gibt das unedlere Metall, hier das Zink Elektronen an das edlere Metall, hier das Kupfer, ab. Die leitende Flüssigkeit kann eine Säure oder eine Salzlösung sein. Man nennt diese Flüssigkeiten auch Elektrolyte. Im Beispiel der Kartoffelbatterie ist eine Säure im Spiel, die von der Kartoffel geliefert wird. Es handelt sich dabei um die Phosphorsäure in einer sehr geringer Konzentration. Die Metalle in einer solchen Lösung nennt man dann Elektroden.
Das unedlere Metall löst sich langsam auf und geht als Ionen in die Lösung über. Diese Ionen, im Fall der Kartoffelbatterie Zn2+, reichern sich an und um die Elektrode an. Die im Metall, hier Zink, zurück bleibenden Elektronen reichern diese Elektrode mit einer negativen Ladung an. Aus dem edleren Metall werden Elektronen herausgelöst und gehen ins Elektrolyt über. Das edlere Metall hier Kupfer lädt sich somit positiv auf.
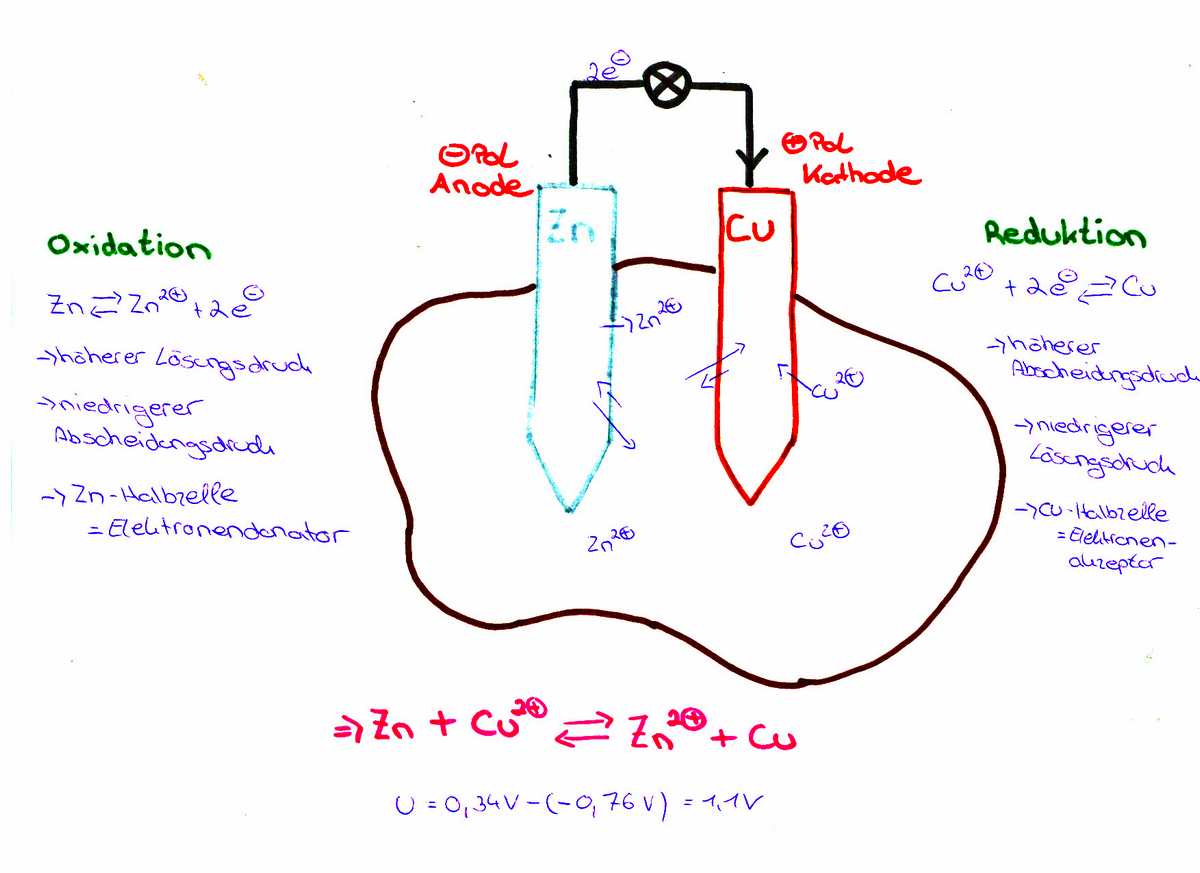 Verbindet man nun beide Metalle (Elektroden) mit einem elektrischen Leiter miteinander, dann fließt ein Strom. Die Ladungen gleichen sich aus.
Verbindet man nun beide Metalle (Elektroden) mit einem elektrischen Leiter miteinander, dann fließt ein Strom. Die Ladungen gleichen sich aus.
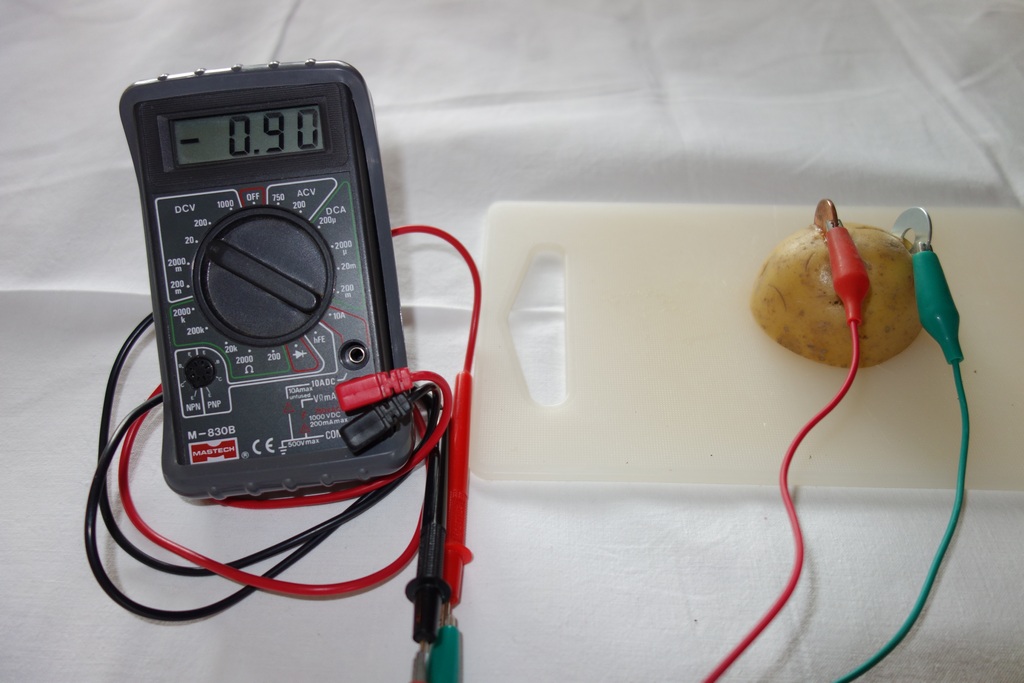
Um die Theorie noch ein wenig weiter zu treiben. Vor allem Metalle lassen sich in einer elektrochemischen Spannungsreihe auflisten. Dabei hat jedes Metall (genauer die Ionen davon) ein sogenanntes Redoxpotential, welches die Bereitschaft beschreibt, Elektronen aufzunehmen oder abzugeben. Bei edleren Metallen ist dieses Potential (und somit auch die Bereitschaft Elektronen aufzunehmen) höher als bei den Ionen unedlerer Metalle. Beim Kupfer somit höher als beim Zink. Die Redoxpotentiale sind nicht direkt messbar, sondern nur die Spannungsdifferenz zu einer Standart-Vergleichselektrode. Als dieser Standard dient die Normal-Wasserstoffelektrode. Kupfer ist in der elektrochemischen Spannungsreihe ein Redoxpotential von +0,35 Volt zugeordnet. Zink hat eine Redoxpotential von -0,75 Volt. D.h, in der Theorie hätte man zwischen den beiden Elektroden eine Spannung von 1,1 Volt messen müssen. Tatsächlich wurden 0,9 Volt gemessen, was sicherlich auch an der Unzulänglichkeit der gewählten Materialien liegt. Durch die Kombination von verschiedenen Metallen ergeben sich unterschiedliche Potentiale zwischen den beiden Elektroden.
Hier noch die Redoxpotentiale von einigen Substanzen mit denen man experimentieren kann:
| Material | Redoxpotential |
| Gold | + 1,4 Volt |
| Silber | + 0,8 Volt |
| Kupfer | +0,35 Volt |
| Blei | – 0,13 Volt |
| Zink | – 0,75 Volt |
| Aluminium | – 1,66 Volt |





Hallo Ich frage mich ob im Salz Wasser Glass zum Salz Kristall züchten und links am Glass Aluminium und rechts Kupfer verbunden mit einem Led wie bei der Kartoffel Batterie und in der Mitte ein Woll Faden zum Kristalle züchten der Salz Kristall sich Überhaupt bilden kann da er sich aus Ionen anordnet ?